2023-04-20 10:14 來(lái)源:昭通新聞網(wǎng)

近年來(lái),電化學(xué)知識(shí)在全國(guó)卷和自主命題省卷中出現(xiàn)的概率均為100%,屬于必考題。這類題承載著對(duì)電化學(xué)原理的考查,體現(xiàn)化學(xué)在解決能源問(wèn)題中的重要作用。試題考查方向:一是原電池工作原理的應(yīng)用;二是電解池工作原理的應(yīng)用;三是二次電池;四是多池的串聯(lián)。高頻考點(diǎn)主要集中在判斷電極名稱、判斷離子和電子的移動(dòng)方向、判斷電極反應(yīng)式和總反應(yīng)式的正誤、判斷電解質(zhì)溶液的變化、判斷隔膜的類型及作用、判斷電極產(chǎn)物以及定量計(jì)算等,其中電極反應(yīng)式和總反應(yīng)式正誤的判斷屬于必考點(diǎn)。
此類題難度不大,但是考生得分率卻不高。其實(shí)電化學(xué)所涉及的核心知識(shí)點(diǎn)相對(duì)較少,只要考生掌握相關(guān)基礎(chǔ)知識(shí)、具備解題的關(guān)鍵能力,極易在短時(shí)間內(nèi)突擊拿分。本文將通過(guò)一道高考題對(duì)電化學(xué)這部分的常考點(diǎn)進(jìn)行復(fù)習(xí)歸納,希望能對(duì)考生有所幫助。
【例】(2022·全國(guó)乙卷)Li-O2電池比能量高,在汽車、航天等領(lǐng)域具有良好的應(yīng)用前景。近年來(lái)科學(xué)家研究了一種光照充電Li-O2電池(如圖所示)。
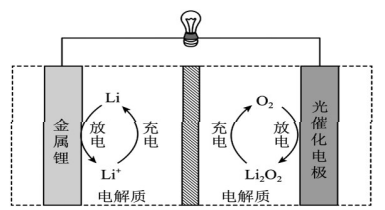
光照時(shí),光催化電極產(chǎn)生電子(e-)和空穴(h+),驅(qū)動(dòng)陰極反應(yīng)(Li++e-=Li)和陽(yáng)極反應(yīng)(Li2O2+2h+=2Li++O2)對(duì)電池進(jìn)行充電。下列敘述錯(cuò)誤的是( )
A.充電時(shí),電池的總反應(yīng)Li2O2=2Li+O2
B.充電效率與光照產(chǎn)生的電子和空穴量有關(guān)
C.放電時(shí),Li+從正極穿過(guò)離子交換膜向負(fù)極遷移
D.放電時(shí),正極發(fā)生反應(yīng)O2+2Li++2e-=Li2O2
本題以可進(jìn)行光照充電的Li-O2電池作為情境,該電池為近年來(lái)的研究成果,屬于新型電池裝置,且充電方式也非常新穎,但考查的知識(shí)點(diǎn)還是原電池和電解池工作原理等必備知識(shí),同時(shí)考查了學(xué)生信息獲取與加工能力、邏輯推理與論證能力和批判性思維能力。
試題分析:本題通過(guò)題給圖示可判斷充電時(shí)光催化電極為陽(yáng)極,Li2O2失電子生成O2,金屬鋰為陰極,Li+得電子生成Li,則充電時(shí)總反應(yīng)為L(zhǎng)i2O2=2Li+O2,A正確。放電時(shí)鋰為負(fù)極,Li失電子生成Li+,光催化電極為正極,O2在正極得電子生成Li2O2,則放電時(shí)正極反應(yīng)為O2+2Li++2e-=Li2O2,D正確。
鏈接基礎(chǔ):一、電極反應(yīng)式的書寫——找兩物、定得失、判電荷、查守恒
(1)原電池電極反應(yīng)式的書寫步驟
第一步:分析化學(xué)反應(yīng),明確氧化劑和還原劑,寫出化合價(jià)變化的微粒。第二步:根據(jù)得失電子守恒確定變價(jià)微粒系數(shù)。第三步:分析電解液的酸堿性,再利用H+(酸性)或OH-(堿性)配平電荷,最后利用水使原子守恒。
(2)電解池電極反應(yīng)式的書寫步驟
第一步:明確電解池陰陽(yáng)極電極材料及溶液中存在的離子。第二步:根據(jù)離子放電順序,確定放電離子。第三步:根據(jù)氧化還原反應(yīng)規(guī)律寫出陰陽(yáng)兩極電極反應(yīng)式和電解總反應(yīng)方程式。
注意:(1)讓兩電極反應(yīng)的得失電子數(shù)相同,然后將兩電極反應(yīng)式相加即可得到總反應(yīng)方程式。
(2)燃料電池在正極發(fā)生還原反應(yīng)的物質(zhì)一般都是O2,則正極反應(yīng)式:①酸性溶液,O2+4e-+4H+=2H2O;②堿性溶液,O2+4e-+2H2O=4OH-;③熔融氧化物,O2+4e-=2O2-;④熔融碳酸鹽,O2+4e-+2CO2=2CO32-,然后利用電池總反應(yīng)式和正極反應(yīng)式寫出負(fù)極反應(yīng)式。
(3)牢記電解池中陰陽(yáng)極微粒的放電順序。①陽(yáng)極放電順序:若是活性電極(金屬活動(dòng)順序表Ag及以前金屬)作陽(yáng)極,則是電極本身失電子放電。如:Fe-2e-= Fe2+ 或Cu-2e-= Cu2+;若是惰性電極(Pt、Au、石墨)作陽(yáng)極,則是溶液中的陰離子放電。常見陰離子的放電順序是:S2->I->Br->Cl-> OH-。②陰極放電順序:常見陽(yáng)離子的放電順序?yàn)锳g+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>A13+>……>K+。
二次電池的電極反應(yīng)關(guān)系——先原電,后電解,負(fù)變陰,正變陽(yáng)。

試題分析:題給信息“光照時(shí),光催化電極產(chǎn)生電子(e-)和空穴(h+),驅(qū)動(dòng)陰極反應(yīng)(Li++e-=Li)和陽(yáng)極反應(yīng)(Li2O2+2h+=2Li++O2)對(duì)電池進(jìn)行充電”,說(shuō)明充電效率與光照產(chǎn)生的電子和空穴量有關(guān),B正確。
放電時(shí),金屬Li電極為負(fù)極,光催化電極為正極,Li+從負(fù)極穿過(guò)離子交換膜向正極遷移,C錯(cuò)誤。
鏈接基礎(chǔ):二、原電池和電解池的工作原理
(1)定義:將化學(xué)能轉(zhuǎn)變?yōu)殡娔艿难b置叫做原電池,將電能轉(zhuǎn)變?yōu)榛瘜W(xué)能的裝置叫做電解池。
(2)工作原理——陽(yáng)負(fù)失升氧,陰正得降還。
①判斷原電池的正負(fù)極。負(fù)極:較活潑金屬,發(fā)生氧化反應(yīng),電子流出的電極。正極:較不活潑的金屬(或石墨),發(fā)生還原反應(yīng),電子流入的電極。
②判斷電解池的陰陽(yáng)極。陽(yáng)極:與電源正極相連的電極,失去電子,發(fā)生氧化反應(yīng)的電極。陰極:與電源負(fù)極相連的電極,得到電子,發(fā)生還原反應(yīng)的電極。
③電子移動(dòng)方向——電子不下水、離子不上岸。原電池:電子由負(fù)極通過(guò)外電路流向正極。電解池:電子從電源負(fù)極流向陰極,再由陽(yáng)極流向電源正極。
④離子移動(dòng)方向——電解池異性相吸,原電池同性相戀。原電池:陽(yáng)離子向正極移動(dòng),陰離子向負(fù)極移動(dòng)。電解池:陽(yáng)離子向陰極移動(dòng),陰離子向陽(yáng)極移動(dòng)。
鏈接基礎(chǔ):三、離子交換膜
電解時(shí),為了保證電極反應(yīng)正常進(jìn)行,阻止兩極區(qū)產(chǎn)生的物質(zhì)接觸,防止發(fā)生化學(xué)反應(yīng),常常將陰陽(yáng)極用離子交換膜隔離開,使電解池變成兩室(或三室)電解池。若為陽(yáng)離子交換膜只允許陽(yáng)離子通過(guò);若為陰離子交換膜只允許陰離子通過(guò);若為質(zhì)子交換膜只允許氫離子通過(guò),不允許其他陽(yáng)離子和陰離子通過(guò)。
總之,電化學(xué)試題屬于必考題,在備課時(shí)要引起足夠的重視。不論多么復(fù)雜陌生的情境都離不開教材中原電池和電解池的模型,所以考生一定要回歸教材,重視基礎(chǔ)知識(shí)、重視常考點(diǎn)。通過(guò)做近幾年的高考試題感知高考考查要求,查找知識(shí)掌握和能力要求上的不足,有針對(duì)性地復(fù)習(xí)并不斷提高解題能力。
教師簡(jiǎn)介:
陳文涓,昭通市第一中學(xué)高級(jí)教師,從教20年,擔(dān)任班主任工作12年,所帶高617班榮獲2021~2022年度“云南省級(jí)先進(jìn)班集體”光榮稱號(hào)。擔(dān)任年級(jí)化學(xué)備課組組長(zhǎng)、昭通市2023屆復(fù)習(xí)備考化學(xué)學(xué)科中心教研組組長(zhǎng),參與了1個(gè)省級(jí)課題、1個(gè)市級(jí)課題的研究。2022年被評(píng)為“昭通市中小學(xué)骨干教師”,多次被評(píng)為“優(yōu)秀教師”。多次承擔(dān)市統(tǒng)測(cè)的命題、審題工作。


