讀新聞 2023-05-06 11:32 來源:昭通新聞網

化學反應方程式,是用化學的語言來描述變化過程中的物質變化。結合題干信息進行方程式的書寫是高考中常見的題型,往往以工藝流程或綜合實驗為載體,給出反應發(fā)生的情境,要求考生寫出相關反應的化學或離子方程式。書寫的過程,是運用基礎知識對題干信息進行轉化和加工的過程。
考生要認真閱讀題干、發(fā)現(xiàn)本質、尋找規(guī)律,完成舊知識在新情境中的正確遷移和運用。下面以2023年云南省第一次高中畢業(yè)生復習統(tǒng)一檢測理綜第27題(節(jié)選)為例,簡單介紹工藝流程題中,信息型反應方程式的書寫。
【例1】(2023年云南省一統(tǒng)第27題節(jié)選)一種高硫錳礦的主要成分為MnCO3,主要雜質為SiO2、CaCO3,還含有少量MnS、FeS、CuS、NiS、FeCO3等,其中FeCO3含量較大。研究人員設計了如下流程,制得了金屬錳。
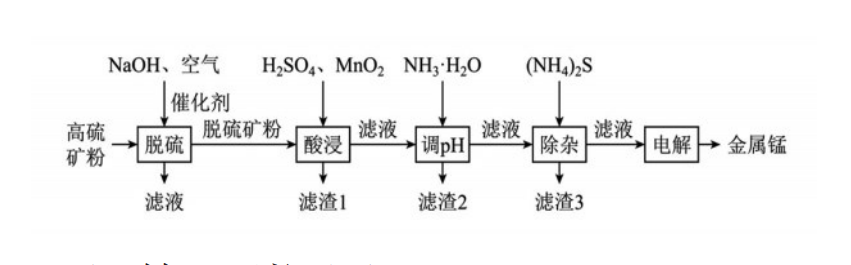
回答下列問題:
(1)堿性溶液中,在催化劑存在下通空氣氧化脫硫,硫化物中硫元素被氧化為單質。寫出硫化亞鐵發(fā)生反應的化學方程式________________________________。
【解析】根據(jù)題干信息,F(xiàn)eS和O2作反應物,生成物為S元素。從氧化還原反應的角度分析,F(xiàn)eS作還原劑,S元素的化合價由-2價升高到0價,生成S單質;Fe元素的化合價由+2價升高到+3價,結合題干信息“堿性溶液”,生成Fe(OH)3。O2作氧化劑,O元素的化合價由0價降低到-2價,則方程式可表示為FeS+O2=S+ Fe(OH)3。根據(jù)原子守恒,在反應物中補充“H2O”,再根據(jù)轉移電子守恒配平方程式。
(4)酸浸時主要含錳組分發(fā)生反應的化學方程式為___________;酸浸時,加入MnO2的作用是___________(用離子方程式表示)。
【解析】①根據(jù)流程圖示信息,“酸浸”時所用的酸為H2SO4,“主要含錳組分”為MnCO3,由此確定反應物為H2SO4+MnCO3。MnCO3屬于碳酸鹽,能與酸發(fā)生復分解反應,生成二氧化碳和水。該反應中無元素化合價發(fā)生變化,為非氧化還原反應。結合質量守恒,確定反應方程式為H2SO4+MnCO3=H2O+MnSO4+CO2↑。
②被硫酸酸浸以后生成的濾液中含F(xiàn)e2+、Fe3+、Mn2+、Cu2+、Ni2+,二氧化錳作氧化劑,F(xiàn)e2+具有還原性,被氧化為Fe3+。根據(jù)轉移電子守恒、電荷守恒、質量守恒的關系,配平后的離子方程式為MnO2+4H++2Fe2+=2H2O+2Fe3++Mn2+。
【方法突破】在書寫工藝流程的反應方程式時,應重點關注題干中的文字描述,并充分結合工藝流程圖,準確判斷參加反應的主要反應物和主要生成物,再結合缺項配平的知識,完成反應方程式的書寫。
除此之外,在綜合實驗題中,往往也會涉及反應方程式的書寫,下面以2022年全國甲卷和乙卷為例,簡單介紹綜合實驗題中,信息型反應方程式的書寫。
【例2】(2022·全國甲卷節(jié)選)硫化鈉可廣泛用于染料、醫(yī)藥行業(yè)。工業(yè)生產的硫化鈉粗品中常含有一定量的煤灰及重金屬硫化物等雜質。硫化鈉易溶于熱乙醇,重金屬硫化物難溶于乙醇。實驗室中常用95%乙醇重結晶純化硫化鈉粗品。回答下列問題:
(1)工業(yè)上常用芒硝(Na2SO4·10H2O)和煤粉在高溫下生產硫化鈉,同時生成CO,該反應的化學方程式為________________________。
【解析】“煤粉”的主要成分為碳單質,具有還原性,結合題干信息,反應后被氧化為CO。 Na2SO4·10H2O作為反應物,被還原為Na2S。由此初步確定反應的方程式為Na2SO4·10H2O+C=Na2S+CO,再根據(jù)原子守恒和轉移電子守恒,確定反應方程式中的物質轉化關系為Na2SO4·10H2O+4C=Na2S+4CO↑+10H2O↑,在等號上補充反應條件為“高溫”,即可完成該方程式的書寫。
【例3】(2022·全國乙卷)二草酸合銅(Ⅱ)酸鉀(K2[Cu(C2O4)2])可用于無機合成、功能材料制備。實驗室制備二草酸合銅(Ⅱ)酸鉀可采用如下步驟:
Ⅰ.取已知濃度的CuSO4溶液,攪拌下滴加足量NaOH溶液,產生淺藍色沉淀。加熱,沉淀轉變成黑色,過濾。
Ⅱ.向草酸(H2C2O4)溶液中加入適量K2CO3固體,制得KHC2O4和K2C2O4混合溶液。
Ⅲ.將Ⅱ的混合溶液加熱至80—85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁熱過濾。
Ⅳ.將Ⅲ的濾液用蒸汽浴加熱濃縮,經一系列操作后,干燥,得到二草酸合銅(Ⅱ)酸鉀晶體,進行表征和分析。 回答下列問題:
(4)Ⅱ中原料配比為n(H2C2O4):n(K2CO3)=1.5:1,寫出反應的化學方程式_______________。
【解析】草酸和碳酸鉀的物質的量之比為1.5:1,在方程式中草酸和碳酸鉀的化學計量數(shù)之比即為1.5:1,轉化為最簡整數(shù)比為3:2。草酸和碳酸鉀發(fā)生非氧化還原反應生成KHC2O4和K2C2O4、CO2和水,依據(jù)原子守恒可知,反應的化學方程式為3H2C2O4+2K2CO3=2KHC2O4+K2C2O4+2H2O+2CO2↑。
【方法突破】信息型反應方程式的書寫,需結合元素及其化合物的性質,綜合運用氧化還原反應、離子反應的基礎知識,結合題目的真實情境,才能正確寫出。在復習備考的過程中,應重點關注以上知識的歸納整理,夯實基礎,靈活運用。
信息型反應方程式的書寫步驟總結:①讀取題目中的有效信息,根據(jù)信息找出反應的主要反應物和生成物。②根據(jù)反應物和生成物中,相同元素的化合價是否發(fā)生變化,確定所涉及的反應是氧化還原反應,還是非氧化還原反應。③根據(jù)原子守恒和溶液的酸堿性,通過在反應方程式的兩端添加H+、OH-或H2O的形式使方程式兩端的電荷守恒。④依據(jù)質量守恒、電荷守恒(若為氧化還原反應,還需根據(jù)轉移電子守恒)配平相關物質的化學計量數(shù)。
教師簡介:廖正偉,2011年畢業(yè)于四川師范大學化學專業(yè),同年任教于昭通市實驗中學。擔任2023屆昭通市高中化學學科中心教研組副組長。曾負責昭通市實驗員培訓工作,并編寫實驗培訓教材。2021年11月指導的“質量守恒定律”示范課獲昭通市初中課堂教學競賽一等獎;同年12月,在高中“好教育教研聯(lián)盟”課堂教學比賽中獲一等獎。

作者:廖正偉




主辦:中共昭通市委宣傳部、市政府新聞辦;承辦:昭通日報社;Copyright ? 2017-2028 昭通報業(yè)有限責任公司
新聞爆料、涉未成年人舉報、涉毒及有害信息舉報:0870-3191933 舉報郵箱:[email protected],涉毒舉報,疫情求助
登報作廢:0870-3191969,流量造假、黑公關、網絡水軍舉報電話:0870-2159980
昭通市“打假治敲”舉報電話:0870-2132590,舉報郵箱:[email protected],舉報地址:昭通市昭陽區(qū)公園路45號市委宣傳部(市委大院內)
滇ICP備19003243號-3 ;云南省公安廳備案號:53060203202019;互聯(lián)網信息新聞許可證編號:53120180014;互聯(lián)網出版許可證:(總)網出證(云)字第002號
本網站法律顧問——云南意衡律師事務所 趙文律師,未經昭通新聞網書面特別授權,請勿轉載或建立鏡像,違者依法必究 。
